MENGENAL ISTILAH UMUM PADA QUALITY BY DESIGN (QbD)
MENGENAL ISTILAH UMUM PADA QUALITY BY DESIGN (QbD)
Oleh: Subhan Asfari (Inspektur CPOTB)
Quality by Design (QbD) adalah pendekatan sistematis dalam mengembangkan sediaan farmasi, yang dimulai dengan penetapan profil tujuan akhir yang jelas. Metode ini menekankan pentingnya memahami produk, proses pembuatannya, dan cara mengendalikan proses tersebut. QbD didasarkan pada sains yang kuat dan prinsip manajemen risiko mutu.
Quality by Design (QbD) sebenarnya bukanlah konsep yang sepenuhnya baru. Gagasan ini pertama kali diperkenalkan oleh Dr. Joseph M. Juran --seorang insinyur elektro lulusan Universitas Minnesota-- pada pertengahan tahun 1980-an. Saat ini, pendekatan QbD semakin luas diterapkan oleh Industri Farmasi dan Industri Obat Tradisional, terutama setelah prinsip-prinsipnya dimuat dalam pedoman Cara Pembuatan Obat yang Baik (CPOB) dan Cara Pembuatan Obat Tradisional yang Baik (CPOTB). Dr. Juran berpendapat bahwa mutu produk harus dirancang sejak awal proses pengembangan. Ia percaya bahwa sebagian besar masalah mutu sebenarnya berakar dari kesalahan pada tahap perancangan produk.
Penerapan konsep Quality by Design (QbD) dalam pengembangan obat, obat bahan alam, dan suplemen kesehatan bertujuan untuk memastikan produk yang dihasilkan benar-benar aman, bermutu, dan bermanfaat bagi konsumen.
Beberapa tujuan utama dari pendekatan ini meliputi:
- Menetapkan standar mutu yang relevan, yang didasarkan pada bagaimana produk bekerja saat digunakan oleh konsumen.
- Meningkatkan keandalan proses produksi, dengan cara merancang produk dan proses secara lebih baik, serta memahami dan mengendalikan proses tersebut agar variasi dan cacat mutu dapat dikurangi.
- Meningkatkan efisiensi, baik dalam tahapan pengembangan produk maupun dalam proses produksinya.
- Mempermudah penanganan masalah, karena QbD membantu dalam mengidentifikasi akar penyebab jika terjadi kendala, serta mendukung pengelolaan perubahan setelah produk mendapat persetujuan.
Alur Pengembangan produk sesuai prinsip QbD (disadur dari ISPE, 2011, dengan beberapa penyesuaian):
- Menetapkan Profil Mutu Produk yang Diharapkan (Quality Target Product Profile/QTPP) Tahap ini dimaksud untuk menentukan tujuan mutu akhir dari produk yang ingin dicapai, seperti cara kerja, bentuk sediaan, cara penggunaan, dan keamanan produk.
- Menetapkan Sifat Mutu Kritis (Critical Quality Attributes / CQA). Tujuannya untuk mengidentifikasi karakteristik mutu yang paling penting agar produk aman, bermutu dan dan bermanfaat.
- Pemilihan Proses Produksi (Manufacturing Process Selection). Pada tahap ini, metode dan tahapan produksi yang sesuai ditetapkan agar mencapai sifat mutu yang ditargetkan.
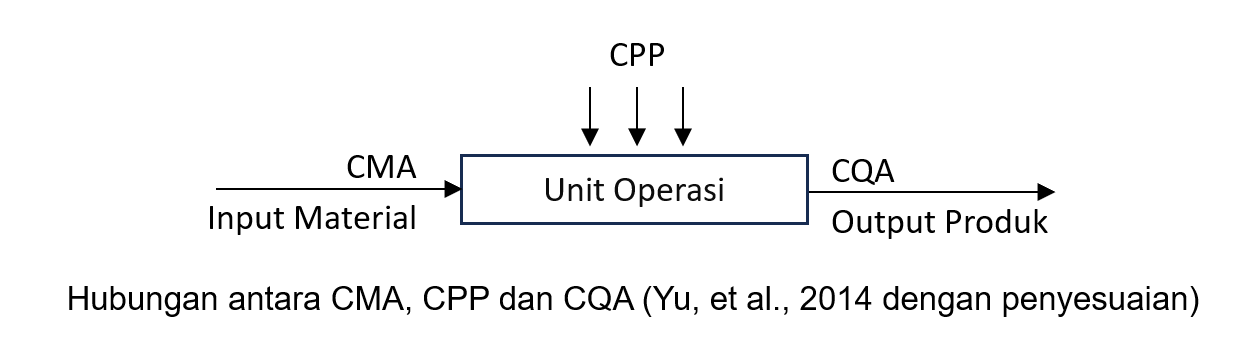
- Analisis Risiko dan Pendekatan Ilmiah (Iterative Risk Assessments and Science). Melakukan penilaian risiko secara berulang dan menggunakan data ilmiah untuk memahami hubungan antara parameter proses kritis (Critical Process Parameter/CPP) dan sifat bahan (Material Attibute/MA) terhadap mutu kritis produk (Critical Quality Attribute/CQA).
- Membuat Ruang Desain (Design Space). Menentukan batas proses yang masih dapat menghasilkan produk bermutu — ini seperti zona aman dalam produksi.
- Strategi Pengendalian (Control Strategy). Menyusun cara-cara untuk memantau dan mengendalikan proses agar tetap dalam ruang desain dan menjaga mutu produk.
- Perbaikan Berkelanjutan (Continual Improvement). Terus melakukan evaluasi dan perbaikan untuk menjaga dan meningkatkan mutu produk dan efisiensi proses produksi dari waktu ke waktu.
Adapun istilah umum yang digunakan dalam QbD antara lain:
- Profil Mutu Produk yang Diharapkan (Quality Target Product Profile/QTPP) adalah gambaran awal tentang standar mutu yang ingin dicapai dari suatu produk obat. Tujuannya adalah untuk memastikan bahwa obat yang dikembangkan nantinya aman digunakan dan memberikan manfaat sesuai yang diharapkan. QTPP disusun sejak tahap awal pengembangan produk dan menjadi panduan penting dalam proses perancangan dan produksi obat.
Dalam menyusun QTPP, beberapa aspek utama yang perlu diperhatikan antara lain:Tujuan penggunaan dan cara pemberian produk, misalnya untuk indikasi apa produk tersebut digunakan, bagaimana cara penggunaannya (ditelan, dibalur, disemprotkan ke hidung dll.), dan bentuk sediaan produk (tablet, kapsul, atau cairan obat dalam).
- Dosis/kekuatan sediaan produk, yaitu jumlah zat aktif yang harus ada dalam setiap kali pemakaian.
- Jenis kemasan, seperti strip, blister, atau kemasan khusus untuk melindungi produk dari kerusakan.
- Cara kerja dan penyerapan obat dalam tubuh, termasuk seberapa cepat obat larut dan tersebar sesuai bentuk sediaannya.
- Standar mutu produk, seperti tingkat kemurnian, kestabilan selama penyimpanan, dan kemampuan obat untuk melepaskan zat aktifnya secara tepat.
Agar QTPP mencerminkan kebutuhan nyata dan mutu yang sesuai, pembentukannya perlu melibatkan tim lintas fungsi, yang terdiri dari para ahli di bidang pengembangan produk, produksi, pengawasan mutu, teknik proses, regulasi dsb. Kolaborasi ini penting agar semua pihak memahami tujuan penggunaan, cara penggunaan di dunia nyata, dan karakteristik pasien yang akan menggunakan obat tersebut.
Menentukan QTPP sejak awal sangatlah penting, karena inilah dasar utama dalam memastikan bahwa obat yang dikembangkan akan memenuhi standar keamanan, mutu, dan khasiat sesuai yang dibutuhkan.
- Critical Quality Attribute (CQA) atau Sifat Mutu yang Kritis adalah sifat fisik, kimia, biologis, atau mikrobiologis dari suatu produk akhir maupun produk antara, yang harus dijaga dalam batas tertentu untuk memastikan bahwa produk tetap aman, bermutu, dan memberikan manfaat sesuai yang diharapkan.
CQA tidak ditentukan secara sembarangan, melainkan diturunkan dari QTPP serta dari pengetahuan yang telah diperoleh melalui pengalaman sebelumnya. Untuk memilih sifat mana yang paling penting, digunakan pendekatan manajemen risiko mutu, yaitu dengan memprioritaskan sifat-sifat yang berpotensi besar memengaruhi QTPP. Sering kali, diperlukan kombinasi antara analisis risiko dan uji coba berulang untuk memahami seberapa besar dampak perubahan suatu sifat terhadap QTPP.
Sebuah sifat akan ditetapkan sebagai CQA apabila, jika berada di luar batas yang ditentukan, dapat menimbulkan dampak serius terhadap konsumen maupun terhadap mutu dan kinerja produk yang dirancang dalam QTPP.
- Critical Material Attribute (CMA) atau Sifat Bahan yang Kritis adalah karakteristik fisik, kimia, biologis, atau mikrobiologis dari bahan yang digunakan dalam proses pembuatan (termasuk bahan aktif maupun eksipien), yang perlu dijaga dalam batas tertentu agar mutu produk akhir dan produk antara tetap terjamin.
Oleh karena bahan aktif dan eksipien memiliki banyak sifat yang berpotensi memengaruhi mutu produk, tidak memungkinkan untuk menguji semua sifat tersebut satu per satu selama tahap pengembangan produk. Oleh karena itu, digunakan pendekatan analisis risiko untuk membantu memilih sifat mana yang paling penting dan perlu diteliti lebih lanjut.
Analisis risiko ini sebaiknya dilakukan berdasarkan pengetahuan ilmiah yang sudah ada dan pengalaman dari proses formulasi sebelumnya. Suatu sifat bahan akan dikategorikan sebagai CMA jika perubahan pada sifat tersebut dapat berdampak signifikan terhadap mutu produk akhir.
CMA sering kali tidak tercantum dalam spesifikasi pemasok atau farmakope, tetapi tetap harus:
- Dipertahankan dalam batas atau rentang tertentu, atau
- Digunakan dalam sistem atau perhitungan untuk mengendalikan proses dan/atau formula, agar mutu produk tetap konsisten sepanjang masa edarnya.
Tingkat pengawasan terhadap CMA juga bergantung pada tingkat risiko yang ditimbulkan oleh variasi dari sifat tersebut. Artinya, jika suatu sifat bahan sangat berpengaruh terhadap mutu dan proses produksi, maka pengendaliannya harus dilakukan secara lebih ketat.
- Parameter proses adalah berbagai pengaturan atau kondisi yang digunakan dalam setiap tahap proses produksi, seperti kecepatan pencampuran, laju aliran, suhu, dan tekanan. Critical Process Parameter (CPP) adalah parameter proses, yang jika nilainya berubah-ubah, bisa berdampak langsung terhadap CQA. Oleh karena itu, CPP seperti ini harus dipantau atau dikendalikan agar proses tetap menghasilkan produk yang memenuhi standar mutu kritis yang ditetapkan (QTPP).
- Design of Experiments (DoE) atau Perancangan Eksperimen adalah metode yang sistematis dan terencana untuk memahami bagaimana berbagai faktor dalam proses produksi saling memengaruhi dan berdampak pada hasil akhirnya. Metode ini digunakan untuk menguji dan mengevaluasi faktor-faktor yang dianggap paling penting atau berisiko tinggi terhadap mutu produk.
Dengan menggunakan DoE, produsen dapat memperoleh pemahaman yang lebih mendalam tentang proses produksi dan menyusun strategi pengendalian mutu yang lebih tepat dan efektif.
Berikut beberapa manfaat utama dari DoE:
- DoE membantu mengevaluasi hubungan antara sifat bahan (CMA) dan parameter proses (CPP), serta bagaimana keduanya dapat memengaruhi mutu akhir produk (CQA).
- Hasil dari DoE, jika dikombinasikan dengan analisis risiko, dapat digunakan untuk menentukan design space, yaitu rentang kondisi proses dan formula yang masih dapat menghasilkan produk dengan mutu yang konsisten.
- Berdasarkan design space tersebut, perusahaan dapat merancang strategi pengendalian mutu (control strategy) yang lebih fleksibel namun tetap menjamin kualitas.
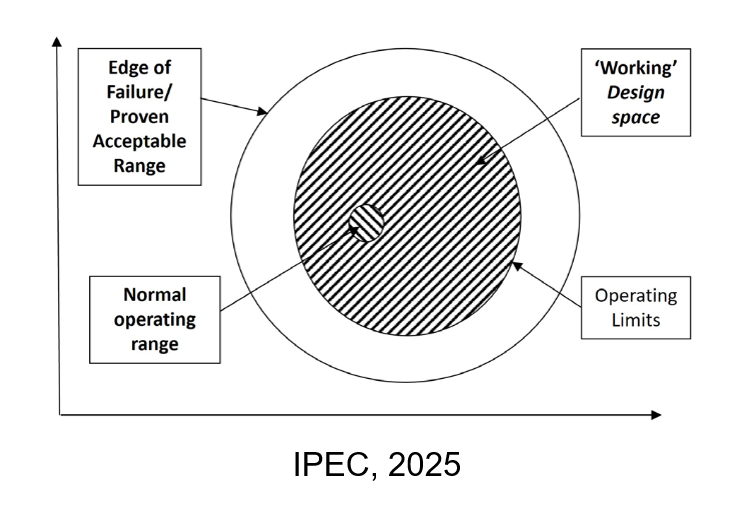
- Ruang Desain (Design Space) adalah suatu kombinasi mutidimensi antara rentang CMA dan/atau CPP yang telah terbukti mampu menghasilkan produk dengan CQA yang konsisten dan terjamin. Selama proses produksi dilakukan dalam rentang ini, maka hal tersebut tidak dianggap sebagai perubahan besar. ICH berpendapat bahwa jika perubahan terjadi dalam rentang ini tidak perlu mengajukan perubahan persetujuan. Namun, jika proses dilakukan di luar batas design space, maka hal itu dianggap sebagai perubahan yang signifikan dan harus dilaporkan serta mendapatkan persetujuan dari otoritas regulatori. Namun, design space ini perlu diusulkan oleh produsen dan dinilai serta disetujui terlebih dahulu oleh otoritas regulatori sebelum diterapkan dalam produksi.
- Strategi Pengendalian (Control Strategy) adalah rencana menyeluruh yang disusun berdasarkan pemahaman yang mendalam tentang produk dan proses produksinya. Tujuan utama dari strategi ini adalah untuk memastikan bahwa proses berjalan dengan stabil dan produk yang dihasilkan selalu memenuhi standar mutu yang ditetapkan.
Strategi ini dirancang setelah dilakukan studi pengembangan secara ilmiah dan terstruktur, yang menghasilkan informasi penting untuk menentukan aspek apa saja yang perlu dikendalikan serta bagaimana cara mengendalikannya. Beberapa hal yang biasanya termasuk dalam Control Strategy antara lain:
- Pengendalian bahan awal, seperti zat aktif, eksipien, produk antara, dan kemasan, dengan mempertimbangkan sejauh hal tersebut memengaruhi kelancaran proses dan QTPP.
- Intervensi spesifikasi mutu produk akhir, yaitu standar mutu yang harus dipenuhi sebelum produk dipasarkan.
- Pengendalian pada tahapan proses tertentu, terutama tahapan yang dapat memengaruhi CQA dan QTPP secara langsung.
- Pengujian selama proses berlangsung (in-process testing) atau langsung di lini produksi, untuk memantau CQA secara real-time, sehingga tidak harus selalu menunggu hasil pengujian akhir.
- Program pemantauan mutu, misalnya pengujian produk secara berkala untuk memastikan bahwa sistem atau model prediksi mutu yang digunakan masih akurat.
Referensi:
- International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH). (2009). ICH harmonised tripartite guideline: Pharmaceutical development Q8(R2). Retrieved from https://database.ich.org/sites/default/files/Q8_R2_Guideline.pdf
- International Society for Pharmaceutical Engineering. (2011). ISPE Guide Series: PQLI® from Concept to Continual Improvement, Part 2 – Product Realization using Quality by Design (QbD): Illustrative Example. International Society for Pharmaceutical Engineering. ISBN: 978-1-936379-23-4.
- The International Pharmaceutical Excipients Council (IPEC). (2025). Incorporation of pharmaceutical excipients into product development using Quality-by-Design (QbD) (Version 2). The International Pharmaceutical Excipients Council, Brussels.
- Yu, L. X., Amidon, G., Khan, M. A., Hoag, S. W., Polli, J., Raju, G. K., & Woodcock, J. (2014). Understanding pharmaceutical quality by design. The AAPS Journal, 16(4), 771–783. https://doi.org/10.1208/s12248-014-9598-3
Disclaimer: Artikel ini disusun dengan bantuan kecerdasan buatan (Artificial Intelligence) untuk kebutuhan parafrase narasi/teks.




 DITWAS OTSK BPOM RI
DITWAS OTSK BPOM RI